page
réalisée par
Gérard
MARTET
professeur
agrégé
service
de biologie
Hôpital
d'Instruction des Armées Laveran, Marseille, France

et par
François
PEYRON
professeur
agrégé
service
de parasitologie
Hôpital
de la Croix Rousse, Lyon, France

mise
à jour : 18 septembre 2000
biologie.hialaveran@wanadoo.fr
peyron@cismsun.univ-lyon1.fr
- L'examen met-il en évidence
un Plasmodium ?
- S'agit-il de Plasmodium
falciparum ?
- S'il s'agit de Plasmodium
falciparum, quelle est la densité parasitaire ?
La difficulté du diagnostic
clinique (forme atypique) et biologique (forme pauci parasitaire) chez
des malades ayant suivi une chimioprophylaxie contraint parfois à
hospitaliser et à multiplier les examens diagnostiques. Le traitement
présomptif reste encore parfois une nécessité.
En zone d'endémie, tout
particulièrement en Afrique, le traitement est donné à
la suite d'un diagnostic clinique où le symptôme majeur
est la fièvre. S'il est pleinement justifié, ce traitement
présomptif des accès fébriles n'apporte pas une
solution pleinement satisfaisante : cette attitude entraîne la
prescription de traitements injustifiés pour des fièvres
non palustres et majore la pression médicamenteuse exercée
sur le parasite. De plus, la chimiorésistance de Plasmodium
falciparum impose des choix thérapeutiques avec des molécules
moins bien tolérées et beaucoup plus onéreuses
que la chloroquine. La résistance à ces nouvelles molécules
peut aussi se développer rapidement si leur usage n'est pas judicieux.
Seule la mise en évidence du parasite peut apporter un diagnostic
de certitude et conduire à un traitement approprié.
retour
au sommaire
Les
outils du diagnostic
C'est l'examen
d'un prélèvement sanguin en microscopie optique qui permet
le diagnostic parasitologique direct. Les tests sérologiques
n'indiquent qu'un contact avec le parasite et ne présentent qu'un
intérêt épidémiologique. Une nouvelle génération
de tests se développe, rendue possible par l'isolement et la
purification d'antigènes provenant de divers stades du développement
parasitaire et par la production d'anticorps monoclonaux spécifiques
de ces antigènes et de forte avidité.
Le diagnostic
microscopique
- Le frottis
sanguin
- la goutte
épaisse
- le QBC-malaria
test®
Mise en évidence
des antigènes parasitaires
- Recherche
de l'HRP2
- D'autres tests sont en préparation,
pour certains en phase d'évaluation. La cible peut être
la recherche des LDH plasmodiales. Les tests multi-espèces
sont pour demain.
- La mise en évidence
des antigènes parasitaires dans les érythrocytes infectés,
solubilisés puis révélés par des techniques
de radio-immunotitrage ou par des techniques immunoenzymatiques (ELISA),
ont été décrites. Elles restent inadaptées
au diagnostic de routine en raison de la difficulté qu'il y
a à standardiser les réactifs utilisés et à
éliminer tous les anticorps anti-palustres de l'échantillon
testé.
Techniques faisant appel
à la biologie moléculaire
Ces techniques sont fondées
sur la détection de séquences caractéristiques
de l'ADN génomique plasmodial à l'aide de sondes d'ADN
dénaturé contenant une séquence nucléotidique
complémentaire d'une séquence répétitive
de l'ADN parasitaire. La PCR (polymerase chain reaction) améliore
les techniques d'hybridation en amplifiant sélectivement une
région du génome du parasite. Mais ces techniques sont
encore du domaine du laboratoire de recherche et elles ne sont pas adaptées
à l'urgence.
La cytométrie de
flux en continu
Cette technique utilise un
cytomètre de flux, appareil sophistiqué et coûteux,
ce qui en limite l'utilisation à quelques laboratoires bien équipés
et disposant de personnel très qualifié.
Elle s'est avérée
capable de déceler automatiquement les hématies parasitées
après marquage de l'ADN parasitaire par le thiazol orange. C'est
une technique très sensible, autorisant une quantification de
la parasitémie, spécifique mais ne permettant pas une
différenciation des espèces.
Les principales caractéristiques
des moyens diagnostiques actuellement utilisables
1. Le frottis sanguin :
- seuil de détection
: 100 HPM (hématies parasitées par microlitre), soit
0,0025 %, soit 1 parasite pour 200 champs.
- avantages : le frottis permet
le diagnostic d'espèce, l'étude de la densité
plasmodiale et celle des signes hématologiques associés.
Il est adapté à l'urgence. Il permet également
le diagnostic d'autres agents pathogènes sanguicoles. Enfin,
il autorise une lecture différée dans le temps et le
lieu, permettant ainsi un contrôle.
- inconvénients : il
nécessite une bonne réalisation technique, la lecture
est longue (20 minutes), le seuil de détection est élevé
et l'apprentissage est indispensable.
2. Le QBC Malaria test®
:
- seuil de détection
: 1 HPM.
- avantages : le seuil de
détection est bas, le test est adapté à l'urgence,
le diagnostic des autres agents pathogènes sanguicoles est
possible, l'apprentissage est simple pour un personnel formé
à la lecture du frottis sanguin.
- inconvénients : le
matériel est onéreux ; le test ne permet pas le diagnostic
d'espèce, l'étude de la densité plasmodiale ni
celle des signes hématologiques associés ; l'apprentissage
nécessite la formation préalabloe à la lecture
du frottis sanguin ; la lecture différée dans le temps
est limitée à cinq jours.
3. La recherche de l'HRP2 :
- seuil de détection
: estimé à 10 HPM. En pratique, la recherche d'HRP2
est toujours positive si la densité parasitaire est > 0,01
%.
- avantages : la technique
permet le diagnostic d'infection à Plasmodium falciparum.
Elle est adaptée à l'urgence et à l'utilisation
sur le terrain. Son apprentissage est simple. La clairance de l'HRP2
étant plus longue que la clairance parasitaire, la technique
permet un diagnostic rétrospectif d'infection par Plasmodium
falciparum. Enfin, elle autorise une lecture différée
dans le temps et dans le lieu.
- inconvénients : la
technique est strictement spécifique de Plasmodium falciparum.
Elle ne permet pas le diagnostic d'autres agents pathogènes
sanguicoles, l'étude de la densité plasmodiale ni celle
des signes hématologiques associés.
retour
au sommaire
La
stratégie diagnostique
Les techniques
usuelles de diagnostic microscopique sont la goutte épaisse et
surtout le frottis sanguin mince. La fiabilité de ces examens
est conditionnée par leur bonne réalisation technique.
L'utilisation
en routine au laboratoire d'analyses médicales de la plupart
des techniques nouvelles de diagnostic parasitologique ne peut être
envisagée avant plusieurs années. Seuls le QBC-malaria
Test® et la recherche d'HRP2, spécifique de Plasmodium
falciparum, présentent actuellement un intérêt
pratique.
Le QBC-malaria
Test® reste le test parasitologique le plus sensible : il doit conserver
sa place en première ligne. La recherche d'HRP2 doit lui être
associée en cas de positivité, systématiquement
pour un biologiste peu entraîné, et quand la parasitémie
est faible.
Quand le QBC-malaria
Test® est négatif, la recherche d'HRP2 n'a d'intérêt
que si l'interrogatoire retrouve un traitement antipaludique dans les
jours qui ont précédé : la mise en évidence
d'HRP2 apporte dans ce cas la preuve de l'origine plasmodiale de la
maladie.
Dans une population
non immune, si le QBC-malaria Test® n'est pas disponible, l'association
frottis sanguin mince - recherche d'HRP2 est nécessaire.
La recherche d'HRP2
est adaptée à une utilisation en situation de précarité
ou d'isolement. Elle doit dans ce cas être considérée
comme un test d'attente en l'absence de recours médical et/ou
biologique.
La présence
de rares faux positifs et l'existence d'autres espèces plasmodiales
interdisent, dans l'attente de tests multi-espèces, l'utilisation
isolée et exclusive de la recherche d'HRP2 pour le diagnostic
biologique du paludisme.
Stratégie
diagnostique dans les laboratoires dotés d'un microscope et d'un
équipement QBC-malaria test®
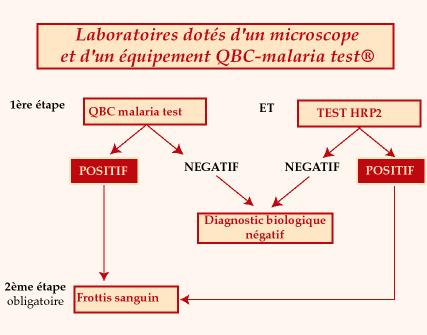
Intérêt
respectif des 3 tests :
- QBC malaria
test®
- diagnostic parasitologique
des plasmodium d'intérêt humain
- diagnostic parasitologique
des autres parasites sanguicoles (trypanosomes, filaires, etc.)
- Recherche de l'antigène
HRP2 :
- argument d'identification
de Plasmodium falciparum quand un plasmodium est mis en évidence
par leQBC malaria test®
- élimine les faux
positifs liés à la lecture du QBC malaria test®
par un personnel non habitué au diagnostic parasitologique
- argument pour incriminer
Plasmodium falciparum quand un malade est vu "en deuxième
main" après un auto-traitement ou un traitement présomptif
ayant abaissé la densité parasitaire en dessous du seuil
de détection des tests parasitologiques
- possibilité de supervision
à distance dans le temps et l'espace
- Frottis sanguin
- évaluation de la
densité parasitaire de Plasmodium falciparum
- diagnostic parasitologique
des plasmodium d'intérêt humain et des autres parasites
sanguicoles
- signes hématologiques
indirects d'infection palustre (syndrome hématologique associant
thrombopénie relative et présence de lymphocytes activés)
- possibilité de supervision
à distance dans le temps et l'espace
Stratégie
diagnostique dans les laboratoires dotés d'un microscope
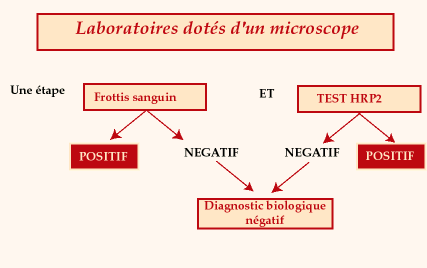
Intérêt
respectif des deux tests :
- Frottis sanguin
- évaluation de la
densité parasitaire de Plasmodium falciparum
- diagnostic parasitologique
des plasmodium d'intérêt humain et des autres parasites
sanguicoles
- signes hématologiques
indirects d'infection palustre (syndrome hématologique associant
thrombopénie relative et présence de lymphocytes activés)
- possibilité de supervision
à distance dans le temps et l'espace
- Recherche de l'antigène
HRP2 :
- confirme l'identification
de Plasmodium falciparum, en particulier quand la densité
parasitaire est trop faible pour une identification parasitologique
sur frottis mince
- argument pour incriminer
Plasmodium falciparum quand un malade est vu "en deuxième
main" après un auto-traitement ou un traitement présomptif
ayant abaissé la densité parasitaire en dessous du seuil
de détection des tests parasitologiques
- possibilité de supervision
à distance dans le temps et l'espace
Diagnostic
sur le terrain
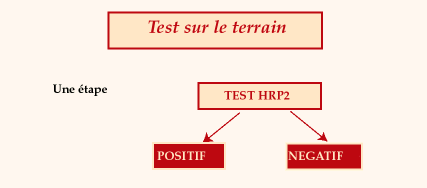
Intérêt
du test :
1. Test positif
- argument majeur pour affirmer
le présence de trophozoïtes de Plasmodium falciparum,
sans pouvoir différencier paludisme infection et paludisme
maladie ce qui, dans ces circonstances, n'a pas de retentissement
sur la conduite à tenir.
- argument pour adapter le
traitement présomptif du paludisme en fonction du niveau local
de résistance de Plasmodium falciparum aux antipaludiques.
- argument pour juger de l'urgence
d'une évacuation sanitaire
- possibilité de supervision
à distance dans le temps et l'espace
2. Test négatif
- argument fort contre le
paludisme maladie ou le paludisme infection par Plasmodium falciparum.
| Cette
stratégie doit être intégrée dans une
stratégie de traitement d'attente et impose une consultation
médicale dès que possible. Elle ne dispense pas de
réaliser en parallèle un frottis sanguin qui sera
lu dans un deuxième temps. Un test négatif ne dispense
pas de réaliser un traitement systématique. |
LE
FROTTIS SANGUIN
1.
CONFECTION DU FROTTIS
Utiliser
des lames parfaitement dégraissées : on lave avec
une poudre à récurer, puis on rince à l'eau,
puis avec un mélange alcool-éther en utilisation
extemporanée.
Recueillir
le sang
Réaliser l'étalement
- idéalement
à l'aide d'une lame rodée, à nettoyer soigneusement
après chaque usage, avec de l'alcool et une compresse.
- à défaut,
à l'aide d'une lamelle (à détruire après
usage).
Le frottis doit être
mince, régulier et comporter une tête, un corps,
une queue et deux bords. Pour cela, l'étalement doit se
faire d'un mouvement régulier, ni trop lent (frottis trop
mince débordant à l'autre extrêmité
de la lame), ni trop rapide (frottis court et épais).
Une fois réalisé,
le frottis doit être séché immédiatement,
manuellement par agitation, ou à l'aide d'un ventilateur.
Il doit être identifié avec précision (nom,
date)à l'aide d'un crayon à papier, en écrivant
sur la tête du frottis, après séchage complet
de ce dernier.
Le stockage se fera à
l'abri des mouches. Si un stockage prolongé, supérieur
à 6 heures, est prévisible, il faut fixer le frottis
au méthanol (bain de 3 minutes ou évaporation d'un
film couvrant le frottis). Il ne faut JAMAIS fixer par flambage
de type bactériologique.
2.
COLORATION DU FROTTIS
Quatre
techniques de coloration peuvent être
utilisées :
- la coloration
de May-Grunwald-Giemsa : c'est celle qui donne les meilleurs
résultats. Les couleurs sont vives et contrastées.
- la coloration
de Giemsa : la technique est plus simple, mais moins discriminante.
- la coloration
panoptique : cette technique très rapide présente
l'inconvénient de donner des teintes "pastel"
nécessitant une certaine habitude pour la lecture.
- la coloration
rapide des frottis RAL 555 : c'est un bon compromis qualité/rapidité.
3.
IDENTIFICATION DES PARASITES
Cette
identification ne peut se faire
que sur un frottis de bonne qualité. Un frottis médiocre
est à l'origine de la plupart des faux positifs.
4.
MESURE DE LA DENSITE PARASITAIRE
La mesure
s'effectue sur tous les frottis où la présence
de Plasmodium falciparum est affirmée et sur les
frottis où persiste une incertitude quant à l'exoèce
plasmodiale. En cas de polyparasitisme d'espèces, la
densité doit être estimée espèce
par espèce.
5.
AIDE AU DIAGNOSTIC
- Attention
au polyparasitisme
- Bioécologie
des plasmodiums
A côté
des éléments biologiques, la connaissance du cycle
des différentes espèces plasmodiales et de leur
répartition géographique apporte des renseignements
intéressants :
- il est
très rare de diagnostiquer Plasmodium vivax chez
un sujet mélanoderme car il existe une résistance
due à l'absence des déterminants antigéniques
Fy a et Fy b (groupe érythrocytaire Duffy).
- il doit
être tenu compte de l'existence d'hypnozoïtes pour
Plasmodium vivax et Plasmodium ovale, qui expliquent
la possibilité de rechute après traitement schizonticide.
- sur
le plan géographique, Plasmodium falciparum est
distribué dans toute la zone intertropicale limitée
par l'isotherme 18°C, Plasmodium vivax se rencontre
dans la zone intertropicale et tempérée chaude.
Il est rare en Afrique, sauf en Afrique du Nord et sur les îles
avoisinnantes (Madagascar et Comores). Plasmodium malariae
se rencontre par tâches dans toute l'Afrique. Plasmodium
ovale est restreint à L'Afrique Centyrale et aux
Comores.
- Pratique
d'un score
Une orientation
diagnostique peut être donnée par la pratique d'un
score, si la densité parasitaire le permet : à
chaque parasite vu, on attribue le nom de l'espèce la
plus probable morphologiquement. Le décompte se fait
sur au moins 50 parasites et l'espèce retenue est celle
qui obtient le score le plus élevé.
ATTENTION
il
ne faut pas faire l'amalgame entre incertitude diagnostique
et
attitude thérapeutique
L'examen
microscopique est actuellement la pièce maitresse du
diagnostic, lorsqu'il est réalisable et bien conduit.
Le diagnostic individuel de paludisme peut donc s'appuyer sur
la microscopie optique à condition toutefois que le résultat
puisse être communiqué rapidement au thérapeute.
retour
au texte principal
|
LA
GOUTTE EPAISSE

Sir Ronald Ross (1903)
La
goutte épaisse, mise au point par Ronald Ross en 1903,
permet l'examen sur une surface de moins de 1 cm2 d'une quantité
de sang relativement importante (3 à 5 microlitres).
Ceci aboutit à une concentration des parasites : le seuil
de positivité du test est évalué à
10 à 20 hématies parasitées par microlitre
(HPM).
Mais
cet avantage est contre-balancé par de nombreux inconvénients,
liés autant à la réalisation technique
qu'à l'interprétation de l'examen :
- Le prélèvement
doit être effectué au bout du doigt car un prélèvement
sur anticoagulant (EDTA) rend plus difficile la confection de
la goutte épaisse.
- Avant de colorer une
goutte épaisse, il faut soit la laisser sécher
24 heures à la température ambiante, soit, à
la rigueur, au moins deux heures à 37°C. Cette donnée
est peu compatible avec un examen en urgence. Des artifices
techniques permettent un séchage accéléré,
mais ils induisent des contraintes matérielles (séchage
au four à micro-ondes).
- Les inconvénients
majeurs apparaissent au moment de la lecture : en effet, la
morphologie des parasites est modifiée et les hématies
parasitées, dont la morphologie est très utile
au diagnostic d'espèce, sont lysées. En outre,
la numération des hématies parasitées n'est
pas non plus réalisable. Seule est envisageable une évaluation
très grossière de la parasitémie faisant
appel à un rapport parasites/leucocytes.
Ainsi, la goutte épaisse
apparaît comme une technique d'enrichissement anciennement
anciennement connue, qui n'est fiable et sensible que lue par
des techniciens par des techniciens très entraînés,
mais qui, même dans des mains expertes, n'est pas utilisable
dans le cadre de l'urgence et ne permet pas de répondre
rapidement aux trois questions posées au biologiste : l'examen
met-il en évidence un Plasmodium ? S'agit-il
de Plasmodium falciparum ? S'il
s'agit de Plasmodium falciparum, quelle est la densité
parasitaire ?
il sera peut-être
nécessaire de préconiser à nouveau une utilisation
large de cette méthode si la disparition annoncée
du QBC Malaria Test® est effective, avant que ne soient développées
d'autres techniques au seuil de détection bas.
|
LE
QBC-malaria test®
1.
PRESENTATION DU TEST
Principe
Ce
test, présenté pour la première fois en
1986 dans une application essentiellement hématologique
et vétérinaire (numération avec approche
de la formule), réalise une coloration à l'état
frais par l'acridine orange des
éléments figurés du sang, séparés
en fonction de leur densité par gravimétrie en
tube microcapillaire de précision.
Le principe
de son utilisation pour le diagnostic parasitologique repose
sur 3 éléments :
- la centrifugation,
qui sépare les éléments en fonction de
leur densité, concentre
et range les éléments identiques à certains
niveaux prévisibles du tube.
- pendant la centrifugation,
un flotteur vient se positionner à cheval sur le manteau
leuco-plaquettaire et la couche érythrocytaire : il provoque
une expansion mécanique des cellules qui l'entourent,
dans l'espace résiduel de 40 µm, au contact de
la paroi du tube où elles seront facilement observables.
- l'acridine orange,
agent intercalant spécifique des acides nucléiques,
après excitation par une source lumineuse appropriée
(UV ou filtrée par dichroïsme), induit chez les
cellules possédant du matériel nucléique
une coloration métachromatique différentielle
entre l'ADN (vert pomme à jaune vert) et l'ARN (vert
à rouge orangé). Elle va révéler
la présence des parasites sur le fond sombre des hématies
a priori dépourvues de structures nucléiques systématisées.
Matériel
1. La trousse est composée
de différents éléments :
- un tube capillaire
à micro-hématocrite, en verre, de 75 mm de long.
Sur les parois internes du tube sont fixés divers réactifs
: acridine orange à une extrêmité ; anticoagulant
(héparinate de sodium, EDTA) à l'extrêmité
opposée ; oxalate de potassium destiné à
accroître la densité de globules rouges par action
osmotique, facilitant ainsi leur séparation d'avec les
globules blancs (notamment entre les réticulocytes et
les granulocytes).
- un flotteur cylindrique
en plastique, de même gravité relative que celle
des leucocytes, mesurant 20 mm de long.
- un bouchon obturateur
en plastique.
2. La mise en oeuvre
nécessite le matériel suivant :
- une centrifugeuse
à micro-hématocrite dont le plateau est équipé
de 20 logettes adaptées à la dimension des tubes,
- un support plastifié,
le "paraviewer", comportant une gouttière destinée
à recevoir le tube et permettant l'examen sur la platine
du microscope,
- un microscope équipé
d'une source de lumière UV et de filtres FITC, d'un objectif
à immersion au grossissement X60 ou X50 et d'une distance
focale ³ 0,34 mm pour s'affranchir de l'épaisseur de
la paroi du tube et pour pouvoir examiner plusieurs épaisseurs
cellulaires.Il existe un modèle de terrain, d'un principe
original, pouvant fonctionner en mode secteur ou sur batterie
: il est adaptable sur tout microscope standard ; il comporte
une source de lumière froide reliée par fibre
optique à un objectif à immersion X60, modifié
par l'adjonction de filtres dichroïques placés sur
le trajet de la lumière, qui permettent l'excitation
de l'acridine orange et l'obtention d'une image fluorescente.
Méthode
1. Le prélèvement
:
L'échantillon
de sang nécessaire, soit 55 à 65 µl, est obtenu
par capillarité à partir de sang veineux prélevé
sur anticoagulant ou de sang capillaire après piqûre
d'un doigt. Le remplissage s'opère au niveau de l'extrêmité
"coatée" en anticoagulants, le niveau de remplissage
étant repéré par deux marques inscrites sur
le tube.
2. La préparation
:
Le tube, pris entre deux
doigts gantés, est alternativement incliné d'un
côté et de l'autre afin de permettre le contact des
éléments figurés du sang avec l'acridine
orange. Un bouchon obturateur est ensuite placé à
l'extrêmité opposée à celle du remplissage,
puis le flotteur est introduit à l'aide d'une pince pour
éviter le contact avec les doigts. Le délai d'attente
avant la centrifugation peut, dans notre expérience, atteindre
5 heures sans altération de la lisibilité. Le tube
ainsi conditionné est déposé dans la centrifugeuse
où il subit une accélération de 12 000 g
pendant 5 minutes.
3. La lecture :
La lecture est possible
immédiatement. Elle permet de visualiser successivement
sous le plasma le manteau plaquettaire, l'anneau lympho-monocytaire,
la couche des granuleux et enfin le sédiment érythrocytaire.
Notre pratique nous montre
que le protocole classique (examen en lumière UV de la
couche érythrocytaire depuis l'interface globules rouges/globules
blancs, sur quelques champs en dessous) peut être pris en
défaut dans certaines situations, en particulier chez les
patients porteurs de gamétocytes de Plasmodium falciparum
et/ou de formes asexuées de Plasmodium vivax, Plasmodium
ovale ou Plasmodium malariae.
2. CONDUITE PRATIQUE
ET CRITERES D'IDENTIFICATION
La conduite pratique
:
Il est préférable
de prélever un échantillon de sang, capillaire ou
veineux, légèrement supérieur à celui
préconisé par le fabricant. Le tube est rempli jusqu'au
milieu, ce qui correspond à une centaine de microlitres.
Dans ces conditions, il n'y a pas de répercussions péjoratives
sur la qualité de la coloration par l'acridine ni sur la
séparation des différentes couches lors de la centrifugation.
Puis le tube est examiné en fluorescence, au grossissement
X50, la mise au point initiale centrée sur la couche érythrocytaire
au niveau de l'interface avec les leucocytes. Le diagnostic positif
est souvent posé instantanément. En cas de négativité,
toute la hauteur du sédiment cellulaire est parcourue en
explorant, pour chaque champ, les quatre principaux plans de netteté
accessibles par le jeu de la vis micrométrique.
Il est indispensable
de rajouter à ce protocole classique une étape fondamentale
qui consiste en l'examen du "buffy coat" sous lumière
blache, i.e. sans fluorescence. Cette étape permet très
facilement d'objectiver, grâce à leur pigment clairement
discernable, les stades sexués des différentes espèces,
qui migrent de façon préférentielle dans
les couches leucocytaires et peuvent ne pas être représentés
dans le sédiment érythrocytaire, notamment en cas
de faible parasitémie. Cette procédure permet également
le repérage des éventuels leucocytes mélanifères,
parfois seuls stigmates d'un contact récent avec le parasite.
Le diagnostic positif
:
La morphologie des parasites
reste très comparable à celle observée sur
frottis sanguin mince, même en cours de traitement. Sur
un fond sombre, où les membranes érythrocytaires
dessinent une résille, les trophozoïtes s'observent
en position intra-érythrocytaire. Le noyau émet
une fluorescence verte intense, homogène, de 1 à
2 µm de diamètre. Le cytoplasme, de taille variable,
émet une fluorescence de vert à orange, moins intense,
à bords nets, en croissant, de largeur et d'épaisseur
variables. Il enserre le noyau entre ses extrêmités
et délimite une zone non fluorescente correspondant à
la vacuole nutritive.
Le diagnostic positif
de trophozoïte repose donc TOUJOURS sur une image associant
un noyau et un cytoplasme, en situation intra-érythrocytaire,
comme on peut le vérifier en variant les plans de netteté.
En cas d'hémolyse
des hématies, la situation intra-érythrocytaire
disparaît, mais la morphologie du parasite est conservée.
Le diagnostic différentiel
:
- La distinction des
parasites et des leucocytes est très facile. La taille
des éléments, comparée à celle des
globules rouges, est discriminante : le noyau du parasite fait
environ 2 µm, celui des leucocytes 5 fois plus ; sa forme
est compacte chez le trophozoïte, lobulée chez le
polynucléaire.
- Ces critères
permettent d'éliminer facilement les débris cellulaires
contaminant éventuellement la couche des hématies
car ils ne forment pas une image systématisée compatible
avec le diagnostic et leur fluorescence rougeâtre s'éteint
en quelques secondes sous excitation lumineuse, contrairement
à celle des parasites.
- De même, les
corps de Jolly se présentent sous la forme d'un point très
brillant, vert pomme, parfaitement circulaire, souvent centré
par un petit point sombre non fluorescent. Parfois, ils sont entourés
d'un lambeau rougeâtre pouvant évoquer un cytoplasme,
mais cette fluorescence s'éteint aussi très rapidement.
- Les plaquettes peuvent
poser un délicat problème car elles contaminent
fréquemment la couche des hématies. En effet, leur
taille est proche de celle d'un trophozoïte et, comme sur
les frottis sanguins, elles se superposent volontiers aux hématies.
Cependant, on ne retrouve pas de morphologie associant noyau et
cytoplasme, mais plutôt un aspect hétérogène
et micro-granulaire de la fluorescence, de tonalité vert
pâle parsemée de ponctuations jaunâtres, aux
limites incertaines. L'examen aux différents niveaux de
netteté.
- Le seul vrai problème
de diagnostic différentiel, qui pourrait exceptionnellement
se poser, est constitué par la distinction entre Plasmodium
et Babesia du fait de la similitude d'aspect, de taille
et de situation intracellulaire. Toutefois, il nous a été
possible de retrouver dans le cas de la babésiose, par
le jeu de la vis micrométrique, un aspect en marguerite
que nous n'avons jamais observé en cas de paludisme.
L'habitude vient rapidement
au lecteur, mais, en cas de doute, il faut considérer qu'UN
ASPECT ATYPIQUE DOIT ETRE RENDU NEGATIF. Le cas limite théorique
est représenté par une parasitémie extrêmement
faible, une morphologie très altérée par
un traitement antérieur à l'examen et la présence
de plaquettes de morphologie anormale, comme il est possible d'en
rencontrer dans le paludisme.
Orientation du diagnostic
d'espèce :
Le diagnostic d'espèce
repose sur un faisceau d'arguments. Dispersion et monomorphisme
de l'image constituent un très bon argument en faveur d'une
infection par Plasmodium falciparum. Polymorphisme et concentration
permettent d'évoquer une autre espèce. Cependant,
il s'agit là de conditions idéales, rarement réalisées
(faible parasitémie, morphologie altérée
par une prise médicamenteuse, présence de deux espèces).
L'examen du frottis mince coloré par le MGG reste indispensable
au diagnostic d'espèce. Il est nécessaire également
à l'évaluation de la densité parasitaire.
Lecture en fluorescence
: étude des couches leucocytaires et des érythrocytes
| |
Plasmodium
falciparum
|
Autres
espèces
|
| Répartion
des hématies parasitées |
homogène
|
concentration
proche des couches leucocytaires
|
| Aspect
général |
monotone
|
bigarré
|
| Morphologie
des trophozoïtes |
jeunes
et réguliers
|
volumineux
et irréguliers
|
| Shizontes
et rosaces |
absents
|
présents
|
| Gamétocytes |
en
banane
|
arrondis
|
Lecture en lumière
blanche : étude des couches leucocytaires
| |
Plasmodium
falciparum
|
Autres
espèces
|
| Pigment
palustre |
absent
|
présent
|
| Schizontes
et rosaces |
absents
|
présents
|
| Gamétocytes |
en
banane
|
arrondis
|
3. PERFORMANCES
DU TEST
Les performances
du test nous paraissent étroitement dépendantes
de la formation du lecteur, de l'utilisation d'un matériel
adéquat, tout particulièrement l'objectif, et d'un
protocole de lecture complet.
Sensibilité,
spécificité :
Les résultats
montrent une supériorité du test face aux méthodes
classiques. Le seuil de détection du test, évalué
sur une cascade de dilutions d'une culture de Plasmodium falciparum
bloquée au stade de trophozoïtes jeunes, est estimé
à 0,1 à 1 hématie parasitée par microlitre
(HPM).
Des études
ont montré que le test dépiste une parasitémie
plus précocément que la goutte épaisse. De
même, la clairance parasitaire est plus élevée
avec ce test (84 ± 13 heures) qu'avec le frottis (66 ±
11 heures). Comparé aux tests de biologie moléculaire
(sondes nucléiques) et de cytométrie de flux, le
QBC reste le plus performant. C'est donc actuellement la méthode
de diagnostic la plus sensible.
En appliquant
les critères de diagnostic positif du genre Plasmodium,
les résultats montrent une spécificité de
100 %.
Faisabilité
:
L'aspect
le plus remarquable du test est sa rapidité de réponse,
même en cas de parasitémie très faible : la
lecture est possible 6 minutes après le prélèvement
et si en moyenne un diagnostic positif est posé en moins
d'une minute, trois minutes suffisent pour rendre un test négatif
aux limites du seuil de détection.
La sécurité
et la simplicité de la mise en oeuvre sont des qualités
éprouvées et approuvées par l'ensemble des
utilisateurs. La qualité du marquage des parasites par
l'acridine orange est constante. Grâce au caractère
très discriminant de l'image du parasite à l'état
frais, l'apprentissage de la lecture avec la reconnaissance formelle
des parasites demande moins de 2 heures à un technicien
déjà formé au diagnostic parasitologique.
Conservé
à l'obscurité à + 4 °C, un tube centrifugé
reste lisible 10 à 15 jours. Ce délai tombe à
48 heures en cas de conservation à + 37 °C. La réalisation
d'un frottis en parallèle permet l'archivage des échantillons
positifs.
4. CONCLUSION
Malgré
ses limites, le QBC-malaria
test® constitue la seule véritable alternative aux
méthodes de référence que sont le frottis
et la goutte épaisse. Il apporte un progrès manifeste
en termes de sensibilité, de rapidité et de fiabilité.
Il est tout à fait adapté au diagnostic et en particulier
à celui des nouvelles formes cliniques pauci-parasitémiques
du paludisme.
Son
intérêt a été prouvé dans les
enquêtes épidémiologiques et il est maintenant
difficile de s'en priver dans ce cadre précis.
Il
est extrêmement regrettable que, sur des arguments purement
économiques, le fabricant ait choisi de ne plus commercialiser
le matériel. Les réactifs sont encore disponibles.
|
LA
RECHERCHE DE L'ANTIGENE HRP2
1.
GENERALITES
Les tests
sont fondés sur la détection de l'Histidine
Rich Protein 2 (HRP2) qui est une glycoprotéine spécifique
de Plasmodium falciparum exposée à la surface
du globule rouge parasité et, en même temps, activement
sécrétée par les parasites intracellulaires.
Sa sécrétion
est constante tout au long du cycle érythrocytaire du
parasite avec un pic au moment de la rupture des schizontes.
L'HRP2
a été isolée sur des souches de Plasmodium
falciparum d'Afrique, d'Asie et d'Amérique du sud.
L'ensemble
de ces critères a conduit au choix de l'HRP2 comme marqueur
de l'infection par Plasmodium falciparum.
La sensibilité
et la spécificité de ces tests, une valeur prédictive
positive très élevée, une bonne stabilité
sur le terrain et l'absence de réaction croisée
avec les autres espèces plasmodiales d'intérêt
humain ont fait rentrer ces tests dans le domaine courant.
2.
PRESENTATION DES TESTS
Ils
se présentent sous forme unitaire. Réalisation
et lecture ne nécessitent aucun appareillage. L'HRP2
est détecté dans un prélèvement
de sang total par adjonction d'un anticorps monoclonal anti-HRP2
couplé à un révélateur coloré.
Le
test ParaSight®-F
Le
test PraSight®-F (Becton Dickinson Tropical Diseases Diagnostics,
Sparks, MD, USA) est un test manuel sur bandelette. Il nécessite
l'utilisation successive de 3 réactifs. Il présente
les qualités de thermorésistance requises pour
une utilisation sur le terrain : 9 mois à température
ambiante et 6 mois à 37°C.
sensibilité
: 93,04 %
spécificité
: 100 %
Le test MalaQuick®
Le test
MalaQuick® (ICT Diagnostics, Sydney, Australie, distribué
en France par les Laboratoires Fumouze) possède l'avantage
d'une utilisation simplifiée. Il est conditionné
en trousses de 2, 3, 5 et 25 tests et n'utilise qu'un seul réactif
liquide. Les tests sont présentés en cartes repliables
qui assurent une conservation du test avec possibilité
de relecture différée et qui limitent le risque
de contact du manipulateur avec le sang du malade. Le fabricant
recommande une conservation en froid positif, mais les études
en zone tropicale comparant les résultats sur trousses
conservées à température ambiante et en
froid positif n'ont pas montré de discordance. Ainsi,
ce test peut être recommandé tant en situation
de précarité qu'en pratique hospitalière.
sensibilité
: 97,39 %
spécificité
: 100 %
3.
CONCLUSIONS
Ces tests
sont d'autant plus utiles qu'ils peuvent s'adresser à
des personnels médicaux et paramédicaux insuffisamment
formés à un diagnostic parasitologique direct.
En zone
d'endémie du paludisme, la recherche d'HRP2 semble répondre
aux critères techniques de l'OMS caractérisant
un test de diagnostic de Plasmodium falciparum adapté
aux structures de soins périphériques ne disposant
pas d'un microscope.
Pour le
diagnostic du paludisme d'importation, ce test ne peut remplacer
les techniques microscopiques du fait de sa spécificité
d'espèce stricte et de son absence de quantification.
Mais il peut leur être associé car sa grande sensibilité
et son seuil de détection bas en font un test d'appoint
très utile pour les faibles parasitémies, surtout
en cas d'automédication préalable.
Ils présentent
plusieurs avantages :
- réalisation
aisée par un personnel non formé aux techniques
parasitologiques
- interprétation
incontestable dans l'immense majorité des cas
- test spécifique
de Plasmodium falciparum, avec les implications thérapeutiques
et opérationnelles que peut entraîner un
résultat positif
- faisabilité
sur le terrain.
Ils ne doivent pas être
utilisés seuls, sauf conditions d'isolement, car ils n'apportent
pas tous les éléments nécessaires à
une prise en charge thérapeutique optimale des accès
fébriles en zone d'endémie palustre :
- spécificité
de Plasmodium falciparum (des tests "multi-espèces"
existent, mais ne sont pas encore commercialisés en France)
- détection des
formes trophozoïtaires seules
- absence de corrélation
entre l'intensité du signal et la densité parasitaire.
|
LES
TECHNIQUES DE COLORATION

1.
LA COLORATION DE MAY-GRUNWALD-GIEMSA
-
Couvrir la lame de 10 gouttes de May-Grunwald pur et laisser
agir 3 minutes.
-
Ajouter sur la lame 10 gouttes d'eau tamponnée et agiter
doucement pour homogénéiser. Laisser agir 1 minute.
-
Renverser le mélange. Ne pas laver.
-
Couvrir la lame à l'aide d'un giemsa dilué préparé
extemporanément en eau tamponné :
- giemsa dilué
au 1/10 pendant 10 minutes
- giemsa dilué
au 1/20 pendant 20 minutes : meilleur contraste
- Laver à l'eau
tamponnée.
- Essuyer la lame du
côté opposé au frottis.
- Sécher : étuve,
séchoir à cheveux, ventilateur.
ATTENTION
LE MAY-GRUNWALD
S'EVENTE CAR IL CONTIENT DE L'ALCOOL
IL FAUT
SYSTEMATIQUEMENT PRATIQUER UNE FIXATION EN PREALABLE A LA COLORATION
2. LA
COLORATION DE GIEMSA
- Fixer
au méthanol.
- Couvrir
la lame avec une dilution de Giemsa au 1/20 préparée
extemporanément à l'aide d'une eau tamponnée.
Laisser agir 20 à 30 minutes (c'est l'expérience
qui permet de déterminer une durée optimale).
- Laver à l'eau
tamponnée.
- Essuyer la lame du
côté opposé au frottis.
- Sécher : étuve,
séchoir à cheveux, ventilateur.
3. LA COLORATION RAPIDE (PANOPTIQUE)
- Couvrir la lame à
l'aide de 10 gouttes de colorant panoptique et laisser agir 90
secondes.
- Ajouter la même
quantité d'adjuvant pour hématologie et laisser
agir 90 secondes.
- Rincer avec ce même
adjuvant.
- Essuyer la lame du
côté opposé au frottis.
- Sécher la lame
immédiatement, en faisant attention car le frottis est
fragile.
|
L'IDENTIFICATION
DES PARASITES
ATTENTION
Cette
identification ne peut se faire que sur un frottis de bonne
qualité.
Un
frottis médiocre est à l'origine de la plupart
des faux positifs.

Alphonse Laveran, découvreur de l'hématozoaire
du paludisme (1870)
La recherche
s'effectue au grossissement 1000 (oculaire 10 et objectif 100),
à l'immersion. La zone du frottis où elle s'effectue
est choisie en fonction de l'étalement : on effectue
la recherche dans la zone où les hématies sont
jointives, mais non superposées. Le balayage dans cette
zone est régulier, transversal, chaque passage étant
décalé afin de ne pas lire plusieurs fois le même
champ.
RECONNAITRE
LE PARASITE
Dans le
sang périphérique, le parasite est intraglobulaire.
C'est un parasite unicellulaire comportant obligatoirement un
notau coloré en rouge et un cytoplasme coloré
en bleu. La mise en évidence de la vacuole nutritive
incolore et du pigment palustre coloré en noir est plus
contingente.
Les
pièges :
- artéfacts
de séchage ou de coloration
- corps étrangers
- projection d'une plaquette
sanguine sur une hématie
RECONNAITRE LE STADE
EVOLUTIF
Le
trophozoïte : c'est
un stade allant de la pénétration du mérozoïte
dans le globule rouge jusqu'à la division du noyau. Le
trophozoïte jeune est caractérisé par un
cytoplasme mince ceinturant la vacuole nutritive. Le noyau est
rejeté en périphérie. Le parasite mesure
jusqu'à 1/3 du diamètre de l'hématie. Au
fur et à mesure de son développement, les modifications
parasitaires sont caractériqées en particulier
par une déformation et une augmentation de volume du
cytoplasme sans division nucléaire.
Le
schizonte : ce
stade est caractérisé par une division nucléaire
non accompagnée de division cytoplasmique. Il s'y associe
un aspect irrégulier et tourmenté du cytoplasme
et une difficulté à visualiser la vacuole nutritive.
La
rosace : elle
représente le stade ultime du schizonte mature. La division
répétée du noyau non accompagnée
de division cytoplasmique aboutit à la formation d'une
cellule parasitaire multinucléée. La vacuole nutritive
a disparu. Le pigment palustre (hémozoïne) est concentré
au centre, les noyaux sont répartis en périphérie.
Leur nombre et leur disposition sont variables selon l'espèce
plasmodiale.
Le
gamétocyte :
les contours du gamétocytes sont arrondis ou ovalaires.
Le noyau est souvent mal individualisé, l'hémozoïne
est souvent abondante. La teinte du cytoplasme varie selon le
sexe du gamétocyte, bleu franc pour les femelles et lilas
pour les mâles. L'absence de vacuole nutritive permet
de différencier gamétocyte et trophozoïte
âgé. La forme en banane est caractéristique
de l'espèce Plasmodium falciparum.
IDENTIFIER
L'ESPECE PLASMODIALE : LES TROIS ETAPES
Aspect
général du frottis :
- Plasmodium falciparum
: parasitisme souvent intense et monotone, avec des parasites
au même stade évolutif, celui de trophozoïte
(pluie d'anneaux). Le polyparasitisme de l'hématie est
fréquent.
- Plasmodium vivax
: parasitisme peu dense avec bigarrure (mélange des différents
stades évolutifs). Le polyparasitisme est exceptionnel.
- Plasmodium malariae
: parasitisme peu dense avec bigarrure et abondance du pigment
palustre.
- Plasmodium ovale
: parasitisme peu dense, bigarrure et possibilité de
polyparasitisme.
Aspect
de l'hématie parasitée :
- Plasmodium falciparum
: taille et forme non modifiée. Les tâches de Maurer,
classiques, sont souvent mal mises en évidence par la
coloration. Ce sont des tâches de taille irrégulière,
peu nombreuses, de couleur brun-rouge. On les compare à
des éraillures en coup d'ongle.
- Plasmodium vivax
: l'hématie est augmentée de volume et apparaît
pâle (deshémoglobinisée). elle est parfois
déformée. Au stade de trophozoïte âgé
et de schizonte, on observe un semis de granulations rondes,
de petite taille, très nombreuses, colorées en
brun rouge : les granulations de Schüffner.
- Plasmodium malariae
: l'hématie est diminuée de volume, sans modification
de forme. Elle est de coloration plus sombre. Le pointillé
de Zieman est très inconstant.
- Plasmodium ovale
: l'hématie est modérément augmentée
de taille. Elle est souvent ovalisée avec une extrémité
frangée. Elle est parfois de teinte pâle, mais
surtout il existe des granulations de Schüffner dès
le stade de trophozoïte jeune.
Aspect
morphologique du parasite :
1. Plasmodium falciparum
:
Le trophozoïte
jeune est petit (1/4 de la taille de l'hématie). Il est
souvent accolé à la paroi de l'hématie
et prend l'aspect de bracelet arabe (noyau bilobé et
cytoplasme fin). Il n'y a pas de pigment palustre.
Le trophozoïte
âgé est plus volumineux et plus irrégulier
(forme de raquette, de filet à papillons).
Le schizonte et la
rosace ne sont généralement pas rencontrés
dans le sang périphérique en dehors des accès
de neuropaludisme à forte parasitémie.
Le gamétocyte
mature est caractéristique : sa forme en cigare, en banane,
déforme l'hématie dont on ne distingue la présence
que difficilement. Sa taille est de 8 à 15 microns.
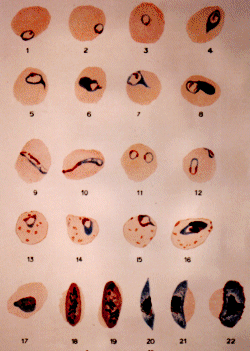
Plasmodium falciparum (d'après
G. Villain)
2. Plasmodium vivax
:
Le trophozoïte
jeune occupe le 1/3 de l'hématie. Le cytoplasme est plus
épais que celui de Plasmodium falciparum. Il n'y
a pas de pigment palustre.
Le trophozoïte
âgé est caractéristique (corps amoeboïde).
Le cytoplasme est étiré en tous sens, déformé,
très polymorphe. La vacuole nutritive est mal délimitée
et le pigment palustre fin.
Le schizonte comporte
des noyaux irréguliers en taille et en répartition
dans le parasite.
La rosace est volumineuse
: elle occupe toute l'hématie et comporte 12 à
18 mérozoïtes irrégulièrement répartis.
Le pigment est rassemblé au centre.
Le gamétocyte
est arrondi ou ovalaire et occupe la quasi totalité de
l'hématie. Le noyau est excentré et le pigment
abondant.
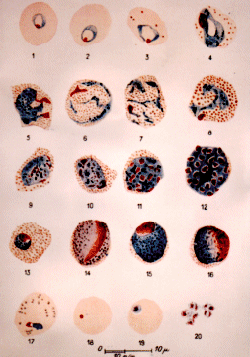
Plasmodium vivax (d'après G. Villain)
3. Plasmodium malariae
:
Le trophozoïte
jeune est comparable en taille et en forme à celui de
Plasmodium vivax, mais à ce stade il possède
un grain de pigment.
Le trophozoïte
âgé est plus volumineux. Le pigment est très
abondant. On retrouve deux aspects classiques : la bande équatoriale,
forme rigide et transversale du parasite dans l'hématie,
et la forme hémogrégariniforme où le parasite
se replie en vermicule, avec un pigment abondant.
Le schizonte ne se
différencie du trophozoïte âgé que
par la division du noyau.
La rosace est caractéristique
par son aspect régulier en marguerite, avec au centre
un pigment palustre très abondant et en périphérie
8 à 12 mérozoïtes régulièrement
répartis.
Le gamétocyte
est globuleux et possède un abondant pigment palustre.
Il occupe la presque totalité de l'hématie.
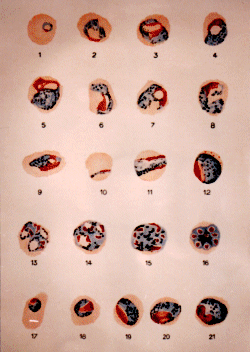
Plasmodium malariae (d'après G.
Villain)
4. Plasmodium ovale
:
Le trophozoïte
jeune est comparable à celui de Plasmodium vivax,
mais il possède souvent un fin grain de pigment.
Le trophozoïte
âgé possède du pigment. Le parasite grossit
et se déforme. A ce stade, le cytoplasme peut posséder
une partie filamenteuse, mais il ne forme jamais de corps amoeboïde.
Le schizonte ne se
différencie du trophozoïta âgé que
par la division du noyau.
La rosace comporte
8 mérozoïtes, parfois plus, répartis plus
ou moins régulièrement. Le pigment est dense,
mais plus fin que chez Plasmodium malariae.
Le gamétocyte
ressemble à celui de Plasmodium vivax, mais il
n'occupe pas toute l'hématie.
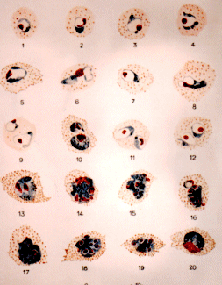
Plasmodium ovale (d'après G. Villain)
CRITERES MAJEURS DE DIAGNOSTIC D'ESPECE
Plasmodium falciparum :
- aspect monotone du
frottis avec pluriparasitisme
- densité parasitaire
parfois très élevée
- hématies parasitées
non déformées
- parasites souvent
jeunes et de petite taille
- absence de rosaces
- gamétocytes
en banane
Plasmodium vivax :
- frottis bigarré
- hématies parasitées
augmentées de volume et deshémoglobinisées
- présence de
granulation de Schüffner au stade de trophozoïte
- rosace irrégulière
à 12 à 18 mérozoïtes
- gamétocyte
occupant la totalité de l'hématie
- corps amoeboïdes
Plasmodium malariae :
- frottis bigarré
- hématies parasitées
diminuées de taille
- pigment palustre très
abondant
- trophozoïte en
bande équatoriale
- rosace très
régulière à 8 à 12 mérozoïtes
- gamétocyte
occupant la totalité de l'hématie
Plasmodium ovale :
- frottis bigarré
avec polyparasitisme fréquent
- hématies parasitées
ovalisées avec extrémité frangée
- granulations de Schüffner
dès le stade de trophozoïte jeune
- rosace irrégulière
à 8 mérozoïtes, parfois plus
- gamétocyte
n'occupant pas la totalité de l'hématie
ATTENTION
En dehors de la découverte
d'un élément de morphologie pathognomonique (gamétocytes
de Plasmodium falciparum, corps amoeboïde de Plasmodium
vivax, bande équatoriale de Plasmodium malariae),
l'identification de l'espèce plasmodiale ne peut que se
faire sur un faisceau d'arguments concordants.
|
|